Για να παραχθεί μια πρωτεΐνη στα ριβοσώματα των κυττάρων, μια αλληλουχία αγγελιοφόρου RNAή mRNΑ μεταφράζεται σε μια σειρά από αμινοξέα. Αυτή η γραμμική, πρωτοταγής δομή, δεν έχει καμιά φυσιολογική λειτουργία και μόνο όταν η πρωτεΐνη αναδιπλωθεί και βρει την τριτοταγή δομή της γίνεται ενεργό συστατικό του κυττάρου. Η υπολογιστική εύρεση της αναδίπλωσης πρωτεϊνών (proteinfolding) είναι ένα πολύ δύσκολο πρόβλημα γιατί αυτό που η φύση κάνει τάχιστα οι υπερυπολογιστες δεν μπορούν να το πραγματοποιήσουν μέσα σε λογικό χρόνο. Να γιατί: Ας πάρουμε μια μικρή πρωτεΐνη με 101 αμινοξέα στη σειρά. Κάθε αμινοξύ συνδέεται με χημικούς δεσμούς με τα δύο γειτονικά του-έχουμε λοιπόν 100 δεσμούς. Κάθε δεσμός είναι σαν μια μικρή ράβδος στον χώρο που χρειάζεται δύο γωνίες για να περιγραφεί. Στην πρωτοταγή δομή οι ράβδοι αυτές είναι σε μια ευθεία, η μία μετά την άλλη και όλες οι γωνίες ίδιες. Όταν η πρωτεΐνη αναδιπλωθεί και γίνει τρισδιάστο κουβάρι οι ράβδοι-δεσμοί κατευθύνονται σε διαφορετικές διευθύνσεις και οι γωνίες τους παίρνουν διαφορετικές τιμές. Αν και οι γωνίες αυτές παίρνουν συνεχείς τιμές μπορούμε για απλότητα να θεωρήσουμε ότι και οι δυό μαζί παίρνουν το πολύ τρείς τιμές, βρίσκεται δηλαδή κάθε ράβδος σε τρείς το πολύ καταστάσεις στο χώρο. Ο πρώτος δεσμός μόνος του μπορεί να βρεθεί στις 3 αυτές καταστάσεις, αλλά μαζί με τον δεύτερο σε 3×3=32καταστάσεις, οι τρείς πρώτοι σε 3x3x3x=33 καταστάσεις, κλπ. Έχουμε δηλαδή 3100 η περίπου 5×1047 συνολικές καταστάσεις της τριτοταγούς δομής της μικρής αυτής πρωτεΐνης μία μόνο εκ των οποίων θα είναι η φυσική μορφή. Ακόμη και αν η πρωτεΐνη ψάχνει να βρει την κατάσταση αυτή με ρυθμό 1015 καταστάσεις το δευτερόλεπτο, ή 3×1022 καταστάσεις ανά έτος, θα χρειαστεί πάνω από 1025 χρόνια μέχρι να βρεί τη φυσική δομή της. Το παράδοξο αυτό του Levinthalδηλώνει ότι η φύση δεν διπλώνει τις πρωτεΐνες με τυχαίο τρόπο[1]. Προφανώς το ίδιο θα πρέπει να κάνουμε και εμείς αν έχουμε στην διάθεσή μας την πρωτοταγή δομή μιας πρωτεΐνης και θέλουμε να βρούμε την φυσική δομή της στον χώρο. Ποιός είναι όμως ο τρόπος που χρησιμοποιεί η φύση; Δυστυχώς δεν είναι γνωστός και κατά συνέπεια το πρόβλημα της υπολογιστικής αναδίπλωσης των πρωτεϊνών είναι ένα πρακτικά άλυτο πρόβλημα. Η μάλλον ήταν.
Πριν μερικούς μήνες η εταιρία DeepMind που συνεργάζεται με τη Google στην τεχνητή νοημοσύνη ανακοίνωσε την επίλυση του προβλήματος της αναδίπλωσης πρωτεϊνών με τη χρήση μεθοδολογίας μηχανικής μάθησης. Στην τελευταία δεν χρησιμοποιούμε τον υπολογιστή για να λύσουμε ένα πρόβλημα. Αντίθετα, εκπαιδεύουμε τον υπολογιστή να λύσει αυτός (η αυτή) το πρόβλημα με δικό του τρόπο. Η εκπαίδευση γίνεται όπως και σε μας, δηλαδή με χρήση γνωστών παραδειγμάτων. Η DeepMind πήρε λοιπόν 170 χιλιάδες πρωτεΐνες των οποίων η πρωτοταγής αλλά και τριτοταγής δομή είναι γνωστή και εκπαίδευσε με αυτές το πρόγραμμα AlphaFold του υπολογιστή της. Με τον τρόπο αυτό ο τελευταίος έμαθε να συνδέει γραμμικές αλληλουχίες αμινοξέων με την τρισδιάστατη δομή της αντίστοιχης φυσικής πρωτεΐνης. Μετά την ολοκλήρωση της χρονοβόρας διαδικασία της μάθησης, έβαλε στον υπολογιστή σαν «διαγώνισμα» την γραμμική αλληλουχία πρωτεΐνης την οποία δεν είχε διδαχθεί και ο υπολογιστής βρήκε με απίθανη ακρίβεια την τρισδιάστατη δομή! Μια κολοσσιαία επιτυχία!
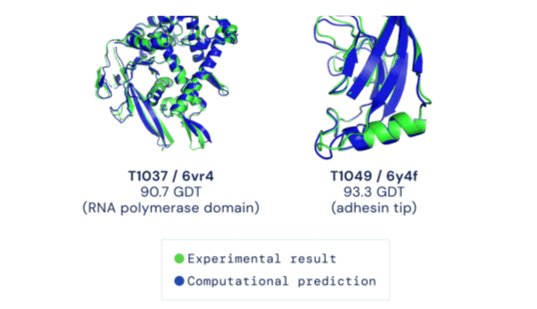
Σχήμα 1: Με την βοήθεια του AlphaFold η εύρεση της τριτοταγούς δομής της πρωτεΐνης γίνεται με πολύ μεγάλη ακρίβεια. Στο σχήμα παρουσιάζονται δύο παραδείγματα [2].
Ποιες είναι οι συνέπειες αυτής της ανακάλυψης; Σε καθαρά μοριακό επίπεδο γίνεται δυνατή η ποσοτική κατανόηση κυτταρικών μηχανισμών. Για παράδειγμα, ο σχεδιασμός φαρμάκων γίνεται απλούστερος μια και η αρχική μελέτη των ιδιοτήτων του πιθανού φαρμάκου γίνεται υπολογιστικά. Η σωρευμένη εμπειρία μεταφέρεται σαν γνώση στο κατάλληλο λογισμικό του υπολογιστή και αυτό με την σειρά του μαθαίνει και έτσι ανακαλύπτει νέες ιδιότητες στο μοριακό-κυτταρικό επίπεδο. Μπορεί αυτή η διαδικασία να μεταφερθεί και σε ψηλότερο επίπεδο, πχ στα όργανα η και ολόκληρο τον οργανισμό; Ας πάρουμε το παράδειγμα της καρδιάς που είναι ένα ζωτικό και αρκετά πολύπλοκο όργανο. Ο καθηγητής του Πανεπιστημίου της Οξφόρδης Denis Noble υποστηρίζει πολλά χρόνια τώρα ότι η δημιουργία μιας «ψηφιακής καρδίας», δηλαδή ενός ακριβούς ψηφιακού αντίγραφου της καρδιάς θα οδηγήσει σε βαθιά κατανόηση της σύνδεσης της λειτουργίας της με τις διάφορες παθήσεις ίσως ακόμη και στο κυτταρικό επίπεδο[3].
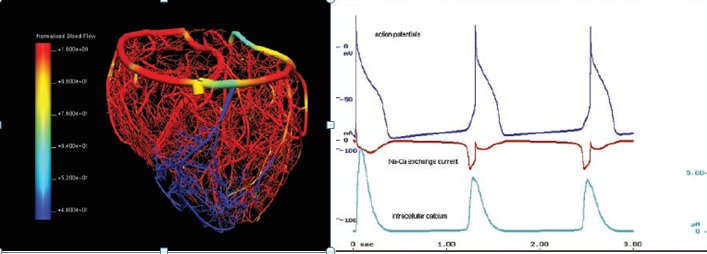
Σχήμα 2: Ψηφιακή καρδιά. Αριστερά: Υπολογιστικό μοντέλο στεφανιαίας κυκλοφορίας στο οποίο έχει εισαχθεί στένωση που εμποδίζει την ροή του αίματος (μπλε). Δεξιά: Προσομοίωση έκτακτων κοιλιακών συστολών από τις ίνες του Purkinje σε συνθήκες ισχαιμίας μυοκαρδίου. Οι περιοδικές μεταβολές στο ασβέστιο (κάτω), προκαλούν εισροή νατρίου-ασβεστίου (μέσον) που με τη σειρά τους επάγουν δυναμικό ενέργειας (πάνω)[3].
Η δημιουργία μιας λεπτομερούς ψηφιακής καρδιάς είναι πρακτικά αδύνατη λόγω του μεγάλου αριθμού των υποσυστημάτων από τα οποία αποτελείται η καρδιά. Δεν φαίνεται, επί του παρόντος, να είναι δυνατή μια συνολική αντιμετώπισή της με υπολογιστικές προσομοιώσεις ξεκινώντας από τους βασικούς μηχανικούς, ηλεκτρικούς και χημικούς νόμους που διέπουν τα συστατικά της. Η μεθοδολογία όμως που εφαρμόστηκε και έλυσε το πρόβλημα της αναδίπλωσης των πρωτεϊνών ίσως δείχνει και ένα νέο τρόπο αντιμετώπισης παράλληλα με τον πιο συμβατικό. Με χρήση δεδομένων και γνώσης που έχει ήδη σωρευτεί θα μπορούσαμε να εκπαιδεύσουμε μια ψηφιακή καρδιά μηχανικής μάθησης η οποία θα γνωρίζει πολλές από τις βασικές λειτουργίες της καρδιάς. Στη συνέχεια, θα μπορούσαμε να εισάγουμε δεδομένα από ένα συγκεκριμένο άτομο, δηλαδή την κλινική του εικόνα, το ηλεκτροκαρδιογράφημά του, κ.λ.π. και να ζητήσουμε από την εκπαιδευμένη ψηφιακή καρδιά να μας υποδείξει πιθανά προβλήματα του οργάνου σε ενδιάμεση η ακόμη και σχεδόν μικροσκοπική κλίμακα. Με τον τρόπο αυτό θα έχουμε μια ακριβή εικόνα για τις παθήσεις του ασθενή. Η επανάσταση που εισάγει η μηχανική μάθηση στην βιολογία σίγουρα θα έχει με τον τρόπο αυτό σημαντικές συνέπειες και στην ιατρική.
[1] Levinthal, C. in Mossbauer Spectroscopy in Biological Systems, Proceedings of a Meeting held at Allerton House, Monticello,IL,eds.Debrunner,P.,Tsibris,J.C.M.& Munck, E.(University of Illinois Press, Urbana),pp.22-24 (1969).
[2] AlphaFold: A solution to a 50-year old grand challenge in biology, www.deepmind.com (November 2020)
[3] Denis Noble, Modeling the heart-from genes to cells to the whole organ, Science 295, 1678 (2002)
Επιμέλεια-Συγγραφή: Γιώργος Τσιρώνης, Kαθηγητής στο Τμήμα Φυσικής και Διευθυντής του Ινστιτούτου Θεωρητικής και Υπολογιστικής Φυσικής του Πανεπιστημίου Κρήτης.
